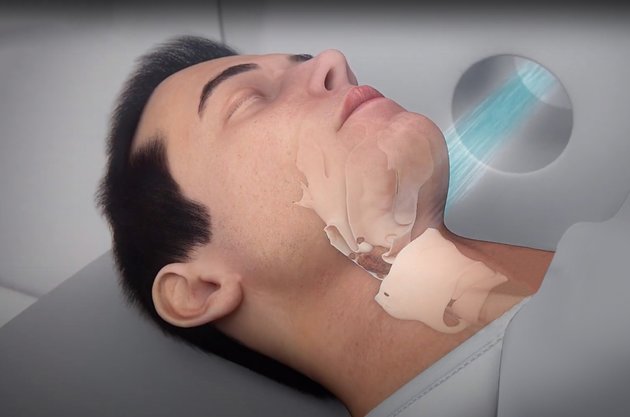
Революционный «ядерный» метод лечения рака, разработанный еще в прошлом веке, до сих пор не применяют в России. Новосибирские физики создали для него идеальный прибор — генератор нейтронов на основе ускорителя заряженных частиц. Но технологию начнут использовать в Китае, где нашлись заинтересованные частные инвесторы...
Около 10 тысяч россиян в год заболевают глиобластомой — злокачественной опухолью головного мозга. Существующее лечение — хирургическое удаление опухоли, затем лучевая и химиотерапия. Но даже с таким агрессивным лечением только пять человек из 100 могут прожить дольше пяти лет. Чаще всего у пациентов есть не больше двух лет.
Новый метод лечения — бор-нейтронозахватная терапия рака (БЗНТ) — позволяет прожить еще шесть-восемь лет. Это доказали в Японии, где «ядерное» лечение прошли 1,7 тысячи человек, и у 60% пациентов с глиобластомой был положительный результат.
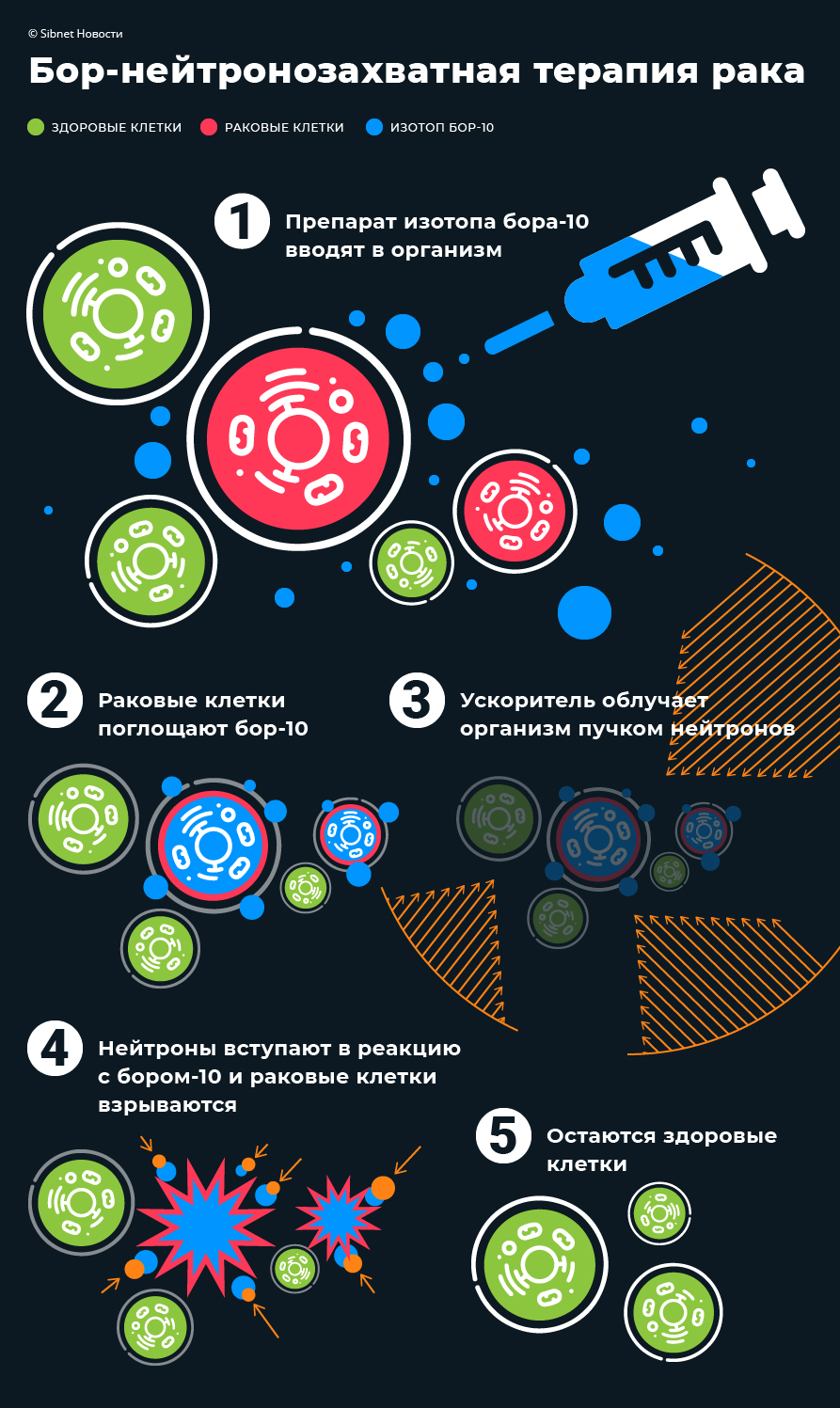
Принцип БЗНТ построен на использовании законов биологии и физики. Пациенту вводят изотоп бора-10, раковые клетки активно «пожирают» введенный препарат, а здоровые отказываются от такого «угощения». Затем человека облучают пучком нейтронов, которые попадая в клетки с препаратом бора-10, вступают с ним в ядерную реакцию.
В результате внутри раковой клетки происходит ядерный взрыв размером 5-7 микрон (размер клетки — 10 микрон), который ее уничтожает. Здоровые клетки при этом никак не страдают. Они получают минимальную дозу радиации.
Чернобыльская фобия
Разработанный еще в 1936 году метод лечения не мог быть внедрен без создания «правильного» источника нейтронов. Пионерами в использовании метода стали японцы, они облучали пациентов с помощью ядерного реактора уже в 1970-е годы. Но у реактора обнаружились существенные недостатки — огромный размер, дорогое обслуживание и излишне мощное излучение.
Кроме того, авария на Чернобыльской АЭС вызвала фобию по отношению к ядерным реакторам, и вопрос внедрения нового метода лечения онкологии в первоначальном варианте сняли.
Появилась задача создать источник нейтронов высокой интенсивности в узком энергетическом диапазоне с использованием ускорителя заряженный частиц и мишеней, генерирующих нейтроны.
Такой подход позволяет генерировать нейтроны, нужные именно для терапии: не слишком быстрые и не слишком медленные, так называемые эпитепловые, и в нужном количестве, исключительно «полезными» дозами. Этот же ускорительный источник нейтронов должен был решить проблему больших габаритов и дороговизны обслуживания ядерного реактора.
«Когда мы предложили ускоритель протонов нового типа, все говорили, что он не будет работать, это невозможно — непривычная геометрия электродов и их огромные размеры. Пришлось сделать эту машину, чтобы доказать, что это работает», — рассказывает главный научный сотрудник ИЯФ СО РАН Сергей Таскаев.

Сначала, по словам ученого, ее собрали из того, что было под рукой. Затем после многих модернизаций она приобрела современный вид, достигла нужных параметров и теперь стабильно работает.
В предложенном новосибирскими физиками устройстве вместо стандартной ускорительной трубки используется конструкция, похожая на кочан капусты, в которой на «кочерыжке»-изоляторе в вакууме установлены вложенные друг в друга «листы»-электроды. Такая конструкция обеспечивает больший темп ускорения частиц по сравнению с традиционной схемой.
Пучок протонов из ускорителя направляется на мишень, покрытую тонким слоем лития. В результате взаимодействия протонов с литием генерируются нейтроны.
«В одной научной статье 2003 года ученые писали, что литиевая мишень идеальна, но не реализуема. Как хорошо, что мы поздно увидели эту статью. Она отлично работает, и теперь после наших научных публикаций ее идеология уже повторяется в решениях других научных команд мира», — говорит Таскаев.

Но 15 лет назад, когда новосибирским физикам удалось решить главную проблему «ядерного» лечения — создать компактный ускоритель с нужным пучком для лечения, никто в России не рискнул вложить в инновацию средства.
Прорыв случился пять лет назад, когда с разработкой познакомились специалисты американской компании TAE Life Sciences (в основном специализируется на безнейтронной термоядерной энергетике), новосибирские физики предложили совместно создать установку для БНЗТ.
Сотрудники института и их американские коллеги разработали и собрали источник нейтронов по заказу китайской компании Neuboron Medtech. В ближайшем будущем с его помощью начнется лечение людей.
От экспериментов к лечению
На ускорительном источнике нейтронов ИЯФ СО РАН группа биологов и врачей на протяжении уже более 10 лет проводит предклинические исследования метода.
Сначала это были клеточные культуры тканей и различных злокачественных клеток, позволяющие отследить на клеточном уровне, какие биологические эффекты возникают после облучения генерируемыми нейтронами. Для системного решения задачи при НГУ в 2017 была создана лаборатория, сотрудниками которой стали врачи-клиницисты, биологи, химики.
«Мы определили оптимальные временные интервалы для облучения, когда максимальное количество раковых клеток погибало, а в нормальных клетках повреждения либо отсутствовали, либо были минимальными и обратимыми», — описал процесс нейрохирург и онколог, завлабораторией медико-биологических проблем БНЗТ НГУ, доцент Владимир Каныгин.
«Только после понимания радиобиологических эффектов мы приступили к следующему этапу исследований на животных. Первыми моделями были мыши с привитыми в организм злокачественными опухолями человека, в том числе глиобластомой», — сказал собеседник.
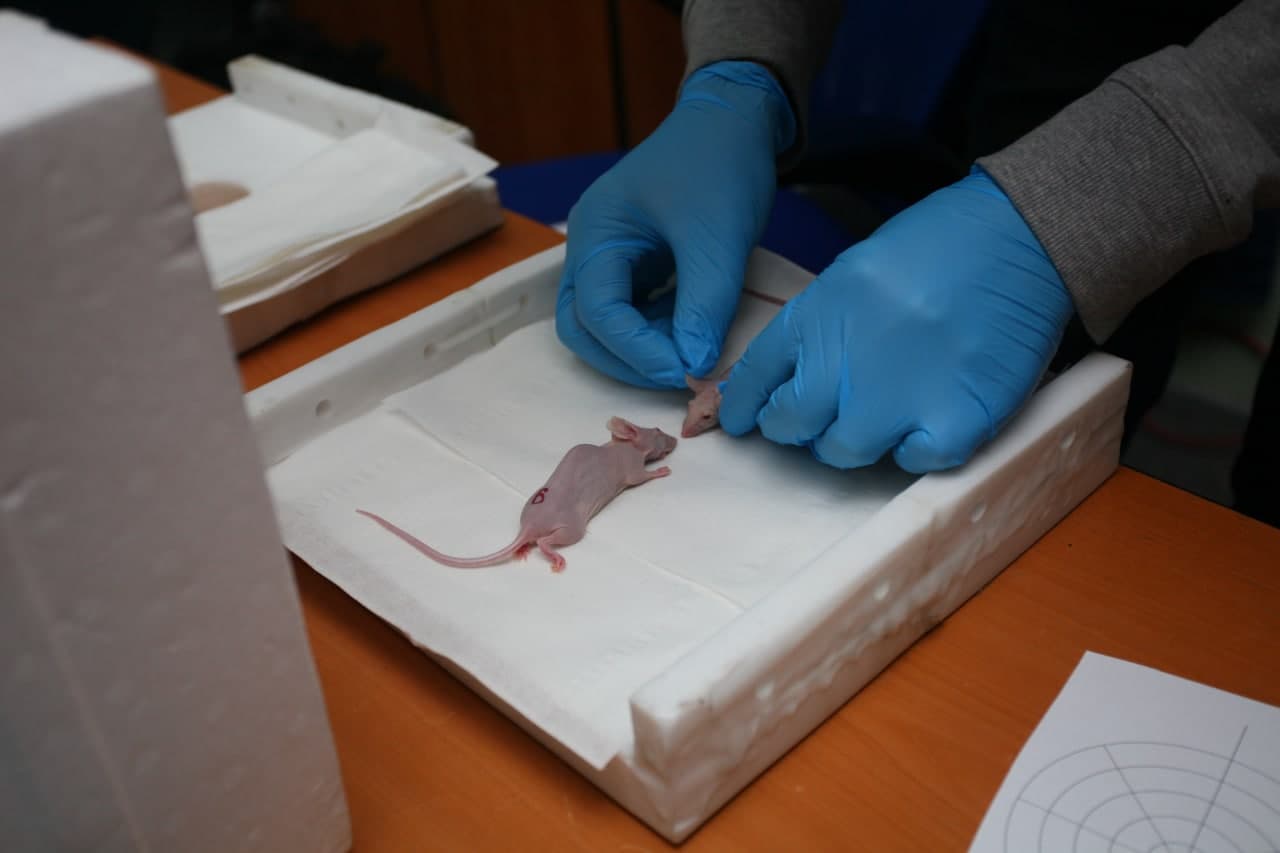
В дальнейшем использовались разные типы злокачественных опухолей — для того, чтобы понять, каковы возможности БНЗТ в лечении широкого спектра онкологических заболеваний.
Проведенные эксперименты на лабораторных мышах с иммунодефицитом и привитыми опухолями показали тренд перспективности методики – опухоли после облучения уменьшались и переставали расти на некоторое время. Однако о существенном увеличении продолжительности жизни у животных и тем более 100% излечении речи быть еще не могло.
И однозначно предполагать, что результаты, полученные на мышах, повторятся при лечении людей, было нельзя. В эксперименте использовались не обычные, а иммунодефицитные мыши, специально адаптированные для прививания раковой опухоли. Кроме того, полностью повторить зарождение опухоли человека в организме животного невозможно.
«Тогда мы пошли дальше — начали лечить крупных животных – кошек и собак с спонтанными злокачественными опухолями», – продолжил Кичигин. У этих животных были неоперабельные опухоли и речь шла об усыплении животного, таким образом БНЗТ стала последней возможностью лечения.
«Мы получили хорошие результаты в виде уменьшения размеров опухоли и замедления ее роста у большинства животных из исследуемой группы», — охарактеризовал итоги эксперимента Каныгин.
У животных были пролечены спонтанные опухоли, которые ближе всего соответствовали по своей природе опухолям у человека, а значит, полученные данные по настройке прибора, используемым дозам препарата бора уже дали надежду, что при лечении человека будут похожие результаты.

Но все эти эксперименты — только подготовка к официальным доклиническим испытаниям, когда животных будут лечить на источнике нейтронов и делать томографию и другие анализы по установленному протоколу. Кроме того, ученым необходимо решить сопутствующую задачу — подобрать оптимальную дозу и тип препарата, содержащего бор-10, для облучения.
«Мы проанализировали результаты и поняли, что проблема во многом связана с препаратом бора, который мы используем в экспериментах, а именно в его недостаточной избирательности накопления в опухолевой ткани», – рассказал сотрудник лаборатории, к.м.н. Александр Кичигин.
На рынке существуют два препарата изотопа бора-10 — борфенилаланин и боркоптат. Оба созданы более полувека назад и не обладают высокой селективностью (различным уровнем накопления в пораженных и здоровых клетках). Кроме того, стоимость лечения ими может составлять до 1,5 миллиона рублей на одного пациента.
Ученым нужно найти варианты препаратов, содержащих больше атомов бора-10, и усовершенствовать способы доставки препарата в раковые клетки, чтобы повысить эффективность и снизить стоимость лечения. Сейчас ученые работают с перспективными наночастицами, которые будут избирательно доставлять бор в опухолевые клетки, и даже построили целую лабораторию по синтезу наночастиц в НГУ.

Сейчас Владимир Каныгин с коллегами в рамках гранта разрабатывает вариант доставки бора с помощью наночастиц и в виде нанолипосом — замкнутых пузырьков, в которых содержится бор.
Липосомы позволяют проникать в клетки опухоли за счет своего размера и мембраны, которая повторяет оболочку клетки. В итоге это позволит адресно доставлять большое количество бора в клетки опухоли и повысить эффективность БНЗТ.
По словам нейрохирурга, лечение может выглядеть так: пациент ложится в клинику, обследуется, затем ему вводят препарат бора-10. Через два-восемь часов (по мере накопления препарата) его облучают на ускорителе. После этого он продолжается наблюдаться в клинике около недели. Лечение может повторяться или совмещаться с другими методами.

«Методика дополняет классические формы лечения, которые уже используются. Конечно, БЗНТ не станет волшебной таблеткой лечения всех видов рака, но потенциально — это один из новых эффективных компонентов комплексной терапии. В этом качестве он будет перспективным методом в руках онкологов», — уверен Каныгин.
Но провести доклинические и клинические испытания, обязательные перед внедрением в здравоохранение, без помощи государства невозможно. А в должном объеме ее пока нет.
Кто даст деньги?
На создание клиники БЗНТ, где будут проведены все необходимые этапы исследований, нужно около 3,6 миллиарда рублей. Но в России частный бизнес, пока не проведены испытания на людях, инвестировать в создание такой клиники не готов.
Во время визита в Новосибирск премьер-министра РФ Михаила Мишустина институт попросил его помочь пройти бюрократические процедуры и выделить средства на строительство клиники БЗНТ в Академгородке. Но просьба удовлетворена не полностью — Институт ядерной физики получит около 800 миллионов рублей на исследования в области бор-нейтронозахватной терапии рака.

«Та сумма, которую мы назвали, — 800 миллионов рублей до конца 2022 года — это действительно абсолютный минимум, который необходим, чтобы завершить основные мероприятия по подготовке к клиническим испытаниям на людях, которые могут начаться в начале 2023 года», — говорил директор ИЯФ СО РАН Павел Логачев.
Пока же людей начнут облучать на такой установке в Китае, так как процедура сертификации в этой стране более простая.
Доклинические и клинические испытания. СПРАВКА
Согласно российскому законодательству, новые методы лечения или лекарства перед внедрением в лечебную практику проходят испытания — доклинические (на животных) и клинические (на людях). Это принцип так называемой доказательной медицины, которая практикуется в современном здравоохранении.
Испытания на животных необходимы для того, чтобы соблюсти базовое врачебное правило – не навредить человеку. Если доклинический результат успешный, новый препарат (или метод) попадает в клинические исследования, которые проводятся уже с участием людей.
Клинические исследования начинаются с фазы I – изучения безопасности препарата на здоровых добровольцах. Далее изучают эффективность, переносимость и другие свойства препарата (или метода).
В среднем доклинические исследования проходят в течение полутора-трех лет. И еще, минимум, несколько лет (срок зависит от специфики препарата) — клинические исследования. И только после этого новый препарат или метод лечения регистрируется и рекомендуется к применению.